2021.06.11
-
array(1) {
[0]=>
object(WP_Term)#1909 (10) {
["term_id"]=>
int(2)
["name"]=>
string(15) "技術コラム"
["slug"]=>
string(45) "%e6%8a%80%e8%a1%93%e3%82%b3%e3%83%a9%e3%83%a0"
["term_group"]=>
int(0)
["term_taxonomy_id"]=>
int(2)
["taxonomy"]=>
string(8) "category"
["description"]=>
string(0) ""
["parent"]=>
int(0)
["count"]=>
int(10)
["filter"]=>
string(3) "raw"
}
}
- 技術コラム
イオン交換樹脂の選択性

イオン交換樹脂には様々な種類があります。この中から最適な種類を選択するには、イオン交換樹脂の特性を認識する必要があります。特に重要な特性が、「選択性」と呼ばれるものです。これはイオン交換樹脂の「イオンの好き嫌い」と言って良いものです。
イオン交換樹脂は内部に移動可能なイオンを持っており、カチオン交換樹脂は+イオン、アニオン交換樹脂は-イオンです。これが水中に含まれるイオンと交換することで「イオン交換反応」が起こります。イオン交換樹脂の母体を有機物全般を示すRとして、+イオンをA+とB+、-イオンをC-とD-とすると、イオン交換反応は次のように書くことが出来ます。
カチオン交換樹脂 A+ + R-B+ ⇆ B+ + R-A+
アニオン交換樹脂 C- + R+D- ⇆ D- + R+C-
このイオン交換反応式を考えると、右方向への反応は「Aイオンのイオン交換吸着反応」となります。この反応は可逆反応で両方の反応が可能となり、この特性を利用し再生が行われ反対方向の反応が起き、再利用可能な状態となります。
イオン交換樹脂の種類や反応するイオンの種類により吸着のしやすさが異なります。一般的に、以下のような特性があります。
- 価数の大きいイオンほど、吸着しやすい。
- 同族元素であれば、原子番号の大きいイオンほど吸着しやすい。
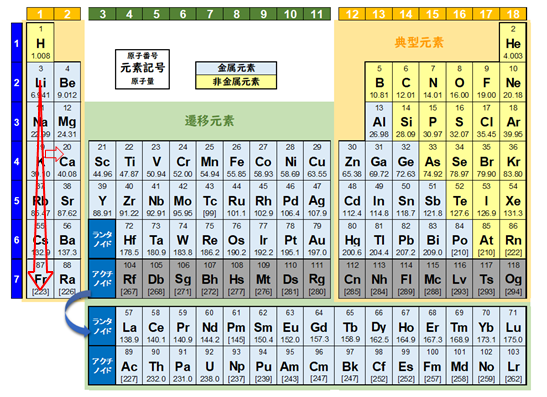
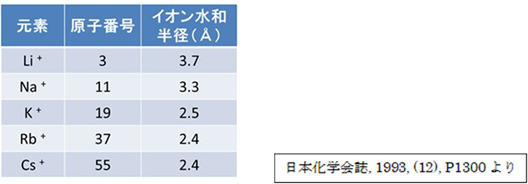
周期律表で見ると、原子番号が大きいイオンほど吸着しやすい特性があります。1族のアルカリ金属は水中で1価の+イオンとして存在しますが、原子番号の小さいリチウムやナトリウムより、原子番号の大きいセシウムの方が吸着しやすい特性があります。これはイオンの大きさに理由があります。水中でのイオンの大きさの指標であるイオン水和半径を見ると、原子番号の大きい元素ほど半径が小さく、イオン交換樹脂で吸着しやすい元素であると言えます。
これはアニオン樹脂でも同様です。17族のハロゲン元素では、原子番号の小さいフッ化物イオンより原子番号の大きい臭化物イオンやヨウ化物イオンの方が吸着しやすい特性があります。
また、イオンの価数が大きいほど、電気的にイオン交換樹脂に吸着しやすい特性を有しています。1価のナトリウムイオンより2価のマグネシウムイオン、更に3価のアルミニウムイオンの方がカチオン交換樹脂に吸着しやすいと言えます。これはアニオン樹脂でも同様です。
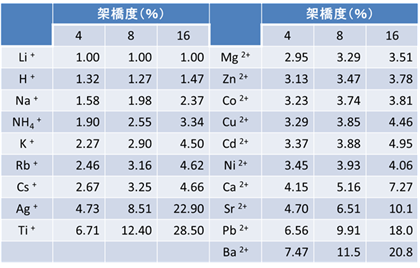
このイオンの種類によるイオン交換樹脂の交換性のし易さ・し難さは、「選択係数」という値で知ることが出来ます。この選択係数の値が高いイオンほど、イオン交換樹脂がそのイオンに対する親和性が強く吸着しやすくなります。強酸性カチオン交換樹脂と強塩基性アニオン交換樹脂の選択係数の例は以下の通りです。
カチオン交換樹脂の選択係数
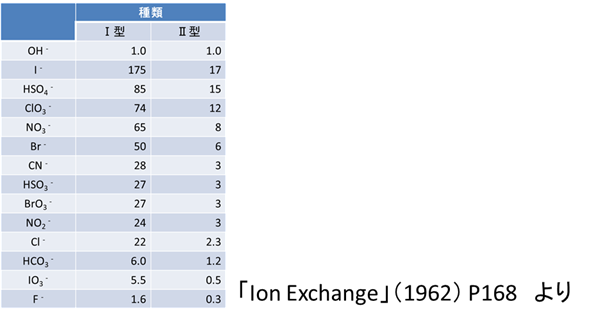
アニオン交換樹脂の選択係数
この表の選択係数の値を見ると、カチオン交換樹脂でイオンの種類で比較するとアルカリ金属で原子番号の小さいリチウムやナトリウムは吸着しにくく、原子番号の大きいバリウムイオンは吸着しやすいことが分かります。
アニオン交換樹脂では、ヨウ化物イオンや硫酸イオンが吸着しやすく、ヨウ素酸イオンやフッ化物イオン、重炭酸イオンなどが吸着しにくいイオン種であると言えます。
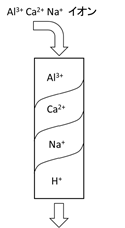
例えばH型カチオン交換樹脂にAL3+, Ca2+, Na+イオンを含む水を上から下に通水すると、図のように、樹脂層の上部に最も吸着しやすいAL3+の吸着帯が存在し、次にCa2+、その下層にNa+の吸着帯が存在し、下部にはイオン交換にあずからないH型の樹脂が存在することとなります。アニオン樹脂の場合も同様で、OH型アニオン交換樹脂にSO42-, Cl–イオンを含む水を通水すると、樹脂層の上部に最も吸着しやすいSO42-の吸着帯が存在し、次にCl–の吸着帯が存在し、下部にはイオン交換にあずからないOH型の樹脂が存在することとなります。
この特性を利用して、水中に存在するイオンが吸着されることとなります。更に、この機能を利用して水中のイオンを分別することが可能となり、「イオンクロマトグラフィー」分析法に活用されています。
カチオン樹脂の場合、強酸性樹脂に比べ弱酸性樹脂は選択係数が小さくなりますが、再生による回復がしやすくなるため、用途により弱酸性樹脂を使用することが稀にあります。一方、アニオン樹脂の場合も同様に強塩基性Ⅰ型>強塩基性Ⅱ型>弱塩基性の順に選択係数が小さくなりますが、再生しやすい特性を活用したり、有機物や金属イオンの吸着を目的として弱塩基性アニオン交換樹脂を使用するケースがあります。
一般に、水中に存在するイオンを吸着させるためにはカチオン交換樹脂とアニオン交換樹脂が用いられますが、選択係数が大きと言っても海水や高濃度の鉱酸中に含まれる微量金属を吸着して回収することは非常に難しい反応です。そこで使用するのが「キレート樹脂」となります。
キレート樹脂は、特定の金属イオンに対する選択性がカチオン樹脂やアニオン樹脂と比較して著しく高いことから、例えば塩化ナトリウム水溶液や高濃度の酸性溶液の様な水溶液中から重金属(銅、水銀、鉛、等)やアルカリ土類金属(カルシウム、マグネシウム、ストロンチウム、等)と錯体を形成して吸着することが出来ます。加えて、pHが変動しなければ再放出することもほとんどありません。選択係数の値でいうと、数100から数1000という値に相当します。
また、キレート樹脂の種類により金属イオンに対する選択性が異なるため、対象となる金属種によりキレート樹脂を選定する必要があります。一例を以下に示しますが、水溶液のpHなどの液性や除去したい金属イオン種により、適切に選定する必要があります。
イミノジ酢酸基:塩濃度の高い溶液からの重金属の除去
イソチオウロニウム基:工業排水中の水銀の除去や酸性液からの貴金属の回収
アミノリン酸基:塩水中の脱カルシウム
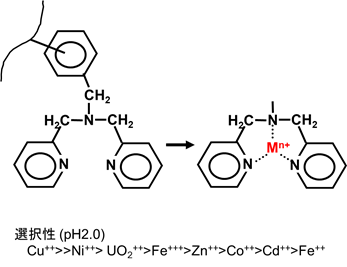
ビスピコリルアミン基:強酸溶液中の銅やニッケルの除去
ビスピコリルアミン基のキレート樹脂の反応(Mが金属イオン)
セミチオカルバミン酸基:有機、無機水銀を選択的に吸着除去
ポリアミン基:アルカリ土類金属を含む排水中の重金属の除去
メチルグルカミン基:ホウ酸イオンの特異的除去
アミドキシム基:海水中のウラン(UO22+)の回収
以上の特性を把握して、最適なイオン交換樹脂を選定することが重要です。
