カチオン樹脂
- TOP
- イオン交換樹脂の種類
- カチオン樹脂
カチオン樹脂の特性
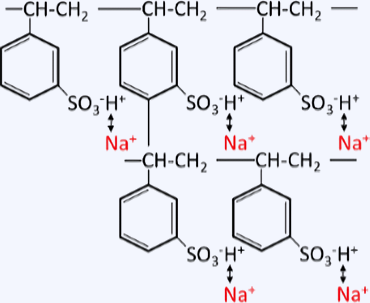
カチオン交換樹脂(陽イオン交換樹脂)は、内部にマイナスの電荷の固定イオンを有し、それを電気的に中和するプラスの電荷のイオンが存在しています。このプラスイオンは他のイオンと交換することが可能なことから、水中に存在する+イオンを吸着する目的で広く使用されています。
カチオン交換樹脂のイオン交換原理
カチオン交換樹脂は大別すると2種類あり、官能基としてスルホン酸基を有する強酸性カチオン交換樹脂と、カルボン酸基を有する弱酸性カチオン交換樹脂があります。
| イオン交換樹脂 | 交換基 | 構造 |
|---|---|---|
| 強酸性カチオン交換樹脂 | スルホン酸基 | 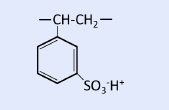 |
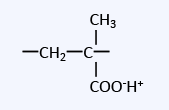
| 弱酸性カチオン交換樹脂 | カルボン酸基 (メタクリル系) |
 |
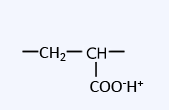
| カルボン酸基 (アクリル系) |
 |
汎用性の高い強酸性カチオン交換樹脂
-
強酸性カチオン交換樹脂は幅広いpH領域で使用でき、どのような+イオンでも吸着可能であることから、純水の製造から排水中の金属回収など、汎用性が高く使用されます。この強酸性カチオン交換樹脂は、ポリスチレンの部分をRで表すとR-SO3Hで表すことができ、スルホン酸基は強酸基であるため水中ではpHに関係なく次のように解離します。
R-SO3H ⇆ R-SO3-(固定されたイオン) + H+(可動できるイオン) -
可動できるイオンが他の+イオンと交換するのがイオン交換反応であり、被交換電解質が塩基性か弱酸塩の場合は次のようにイオン交換します。この反応は中和反応であるため、反応し易くバッチ式でも交換することができます。
R-SO3H + NaOH → R-SO3Na + H2O2R-SO3H + Ca(HCO3)2 →(R-SO3)2Ca + H2CO3 -
被交換電解質が中性塩の場合は交換反応によって鉱酸ができ、これが逆反応を起こすため、交換平衡が成立します。バッチ式でこの交換を行うと交換平衡が成立し、交換反応を完成することは出来ません。
R-SO3H + NaCl ⇆ R-SO3Na + HCl2R-SO3H + CaCl2 ⇆(R-SO3)2Ca + 2HCl -
イオン交換樹脂はイオンの種類によって交換性にし易さ・し難さがあります。一般に、強酸樹脂のイオンの選択性は電荷が高いイオンほど交換捕捉しやすく、また水和イオンの小さいもの(原子番号の大きいもの)ほど交換しやすい傾向があります。この傾向は次の順序になります。
強酸性カチオン交換樹脂:Al3+>Ca2+>Cu2+>Zn2+>Mg2+>K+>NH4+>Na+>H+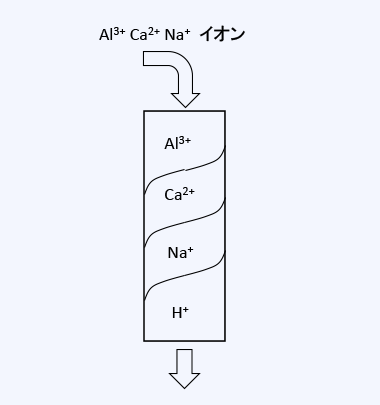
選択性によるイオンの分離例
例えばH型カチオン交換樹脂にAL3+, Ca2+, Na+イオンを含む水を通水すると、図のように、樹脂層の上部に最も吸着しやすいAL3+の吸着帯が存在し、次にCa2+、その下層にNa+の吸着帯が存在し、下部にはイオン交換にあずからないH型の樹脂が存在することとなります。この特性を利用して、水中に存在するイオンが吸着されることとなります。
一方イオン交換反応は可逆性があることから、この特性を活用して「再生」操作が行われます。これは、カチオン交換樹脂のイオン交換反応が進行した時点で、高濃度の薬品を大量に通水することにより、吸着しているイオン種を元の状態に戻す操作です。一般水処理で使用される場合には、Hイオンが吸着したカチオン交換樹脂にNaイオンやCaイオンなどが負荷します。ここに、高濃度のHイオンを含む塩酸や硫酸などの鉱酸を流すことにより、吸着しているイオンをHイオンに戻すことが可能となり、再度、使用できることとなります。
-
弱酸性カチオン交換樹脂も基本的なイオン交換反応の原理は強酸性カチオン交換樹脂と同様ですが、以下のような特徴があります。
- 単位体積当たりの交換容量が大きい
- 再生による交換容量の回復がしやすい
- 酸性領域では使用できない
- イオンの選択性が小さい
これらの特性を生かしたうえで、
弱酸性カチオン交換樹脂は地下水や水道水中の硬度成分(カルシウム、マグネシウム)の除去など、
限定された用途で使用されています。
イオン交換樹脂の種類についてもっと知る
イオン交換樹脂の構造(架橋度・多孔性・粒径) カチオン樹脂 アニオン樹脂 キレート樹脂 高純度樹脂
(高架橋度樹脂)
お問い合わせ Contact
カタログダウンロード
製品に関する資料やカタログが
ダウンロードいただけます。
ご質問やお問い合わせはこちら
お気軽にお問い合わせください。
